Trao đổi về ý kiến của đại diện Bộ Y tế cho rằng xin cấp phép khẩn cấp vaccine Covid-19 là quá sớm và nóng vội, đại diện Công ty CP Công nghệ Sinh học Dược Nangogen (Công ty Nanogen) cho biết hiện nay trên thế giới một số vaccine đang được tiêm mở rộng của Nga, Ấn Độ, Trung Quốc cũng chỉ thử giai đoạn 2 đã xin cấp phép khẩn cấp.
"Thử nghiệm của các nước này cũng chỉ trên 300, 500 người, còn vaccine Nano Covax đã thực hiện nghiên cứu lâm sàng sang giai đoạn 3 và số lượng lên đến nghìn người", đại diện này khẳng định.
Theo đại diện Nanogen, kiến nghị cấp phép khẩn cấp của đơn vị này dựa trên những báo cáo về độ an toàn, kết quả sinh miễn dịch, khả năng trung hoà các biến thể virus mà Học viện Quân Y và Sở Y tế TP.HCM - 2 đơn vị do Bộ Y tế chỉ định cung cấp.
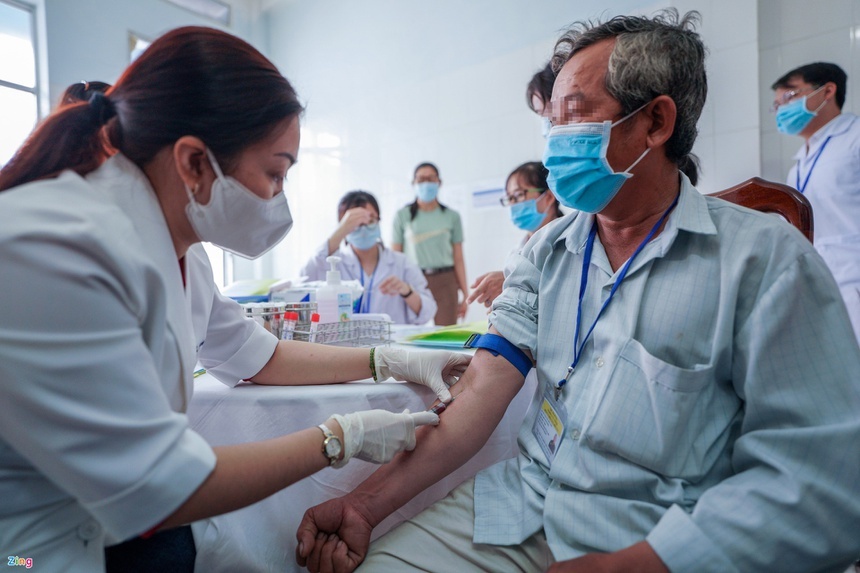 |
| Vaccine Nano Covax đã thực hiện nghiên cứu lâm sàng sang giai đoạn 3 và số lượng lên đến nghìn người. Ảnh: Chí Hùng. |
"Cấp phép nhanh để người dân được sử dụng vaccine"
Ông cho rằng Bộ Y tế đang chưa thống nhất về những quy định của họ vì việc chưa có tiền lệ về việc cấp phép vaccine. "Công ty Nanogen được Nhà nước phân công, giao trách nhiệm để nghiên cứu, sản xuất vaccine và Bộ Y tế là đơn vị phối hợp về chuyên môn. Vấn đề an toàn được chúng tôi đặt lên hàng đầu".
Hiện nay, Nanogen có 4 nhà máy, 3 nhà máy tại TP.HCM với diện tích lần lượt là 5.000 m2, 10.000 m2, 24.000 m2, 1 nhà máy ở Lâm Đồng có diện tích 34.000 m2 và 1 Trung tâm nghiên cứu và phát triển tại Việt Nam với tổng diện tích là 73.000 m2.
"Dựa trên kế hoạch và năng lực hiện tại, công ty dự kiến đến tháng 12 năm nay có thể cung cấp đủ 50 triệu liều và 100 triệu liều vào năm 2022. Công ty Nanogen sẽ đẩy mạnh nghiên cứu, sản xuất để cung cấp đủ vaccine để Việt Nam đạt được miễn dịch cộng đồng vào quý 2/2022", vị đại diện này thông tin.
Quyết định gửi thư xin cấp phép khẩn cấp đến Thủ tướng vì vaccine Nano Covax đã đủ cơ sở dữ liệu khoa học, an toàn.
Đại diện Công ty Nanogen nói.
Đại diện công ty cho biết đơn vị này cũng vừa gửi đơn xin cấp phép cho Bộ trưởng Y tế dựa trên những số liệu khoa học. "Cấp phép nhanh để người dân được sử dụng vaccine", đó là câu khẳng định của đại diện Nanogen với Bộ Y tế.
Đại diện cho biết thời điểm doanh nghiệp quyết định gửi thư cho Thủ tướng xin cấp phép khẩn cấp cho vaccine Nano Covax vì nó đã đủ cơ sở dữ liệu khoa học, đủ an toàn để người dân an tâm quay trở lại cuộc sống bình thường.
"Nếu chúng tôi không nói, cứ âm thầm làm thì khi nào Bộ Y tế không đủ vaccine mới cấp phép. Như thế là không công bằng", đại diện Nanogen nói.
Với bối cảnh số ca nhiễm Covid-19 tại Việt Nam đã vượt mốc hơn 10.000, vị đại diện Nanogen cho rằng việc cấp phép cho vaccine lúc này là rất cấp thiết. "Hiện tại công ty chỉ tập trung sản xuất cho Việt Nam đạt đủ miễn dịch cộng đồng, sau đó mới nghĩ đến chuyện xuất khẩu", ông chia sẻ thêm.
Thử nghiệm lâm sàng giai đoạn 3: Nano Covax sẽ đạt khả năng bảo vệ cao
Đến thời điểm hiện tại, 1.000 tình nguyện viên đã hoàn thành mũi tiêm thứ 2 trong giai đoạn thử nghiệm lâm sàng cuối cùng của vaccine Nano Covax. Trước đó, sau 2 giai đoạn Hội đồng đạo đức Bộ Y tế đánh giá tốt và đã thông qua đề cương nghiên cứu, triển khai thử nghiệm lâm sàng giai đoạn 3 cho Nano Covax hàm lượng 25 mcg trên quy mô 13.000 người.
Đại diện công ty khẳng định Nanogen đang cố gắng đẩy nhanh tiến độ nhưng đảm bảo không cắt đoạn hay bỏ sót giai đoạn, đảm bảo độ an toàn và chính xác cao của giai đoạn 3. Công ty dự kiến và hy vọng tháng 9 sẽ hoàn thành thử nghiệm lâm sàng pha 3 này.
Hai nghiên cứu viên chính của giai đoạn này là Học viện Quân Y ở miền Bắc và Viện Pasteur ở miền Nam. Ngày 15/6, Viện Pasteur khởi động chích thử nghiệm ở site Bến Lức (Long An). Dự kiến sẽ khởi động lâm sàng giai đoạn 3 ở 2 site còn lại là Mỹ Tho và Chợ Gạo.
 |
| Nano Covax là vaccine Covid-19 đầu tiên ở Việt Nam tiến hành thử nghiệm lâm sàng trên người. Ảnh: Văn Nguyện. |
Ngoài ra, đại diện Công ty Naogen cho biết dù đạt độ an toàn 100% và khả năng miễn dịch của Nano Covax là 99,4% nhưng nhờ sử dụng công nghệ nên công ty đã làm chủ được trong hơn 10 năm nay và đảm bảo được nguồn nguyên liệu tốt trên giá bán dự kiến của Nano Covax hiện nay là 120.000 đồng/liều, thấp nhất thế giới.
Kết quả đánh giá ban đầu cho thấy vaccine Nano Covax sinh kháng thể ở tất cả tình nguyện viên tiêm vaccine. Vaccine sinh miễn dịch ở 100% người đã tiêm, tác dụng với biến thể nCoV nguồn gốc Anh và Nam Phi, trong đó Nam Phi là chủng “nguy hiểm”, có khả năng làm giảm hiệu quả của vaccine.
"Không dùng bất kỳ thành phần sống nào của virus nên Nano Covax an toàn và không gây bất kỳ tác dụng phụ nghiêm trọng nào", đại diện công ty khẳng định.
Do không dùng bất kỳ thành phần sống nào của virus nên Nano Covax an toàn và không gây bất kỳ tác dụng phụ nghiêm trọng nào.
Đại diện Công ty Nanogen khẳng định.
Công ty cổ phần công nghệ sinh học dược Nanogen là một trong bốn đơn vị sản xuất vaccine ngừa Covid-19 của Việt Nam. Công ty hoạt động từ năm 1998; chuyên nghiên cứu, phát triển và ứng dụng thành công các tiến bộ của ngành công nghệ sinh học đầu tiên và duy nhất tại Việt Nam trong việc sản xuất nguyên liệu dược và thành phẩm thuốc tiêm đặc trị từ công nghệ DNA/protein tái tổ hợp hàng đầu trong khu vực Châu á Thái Bình Dương. Nhà máy sản xuất của doanh nghiệp này nằm trong Khu công nghệ cao TP.HCM.
Ngày 22/6, Công ty Nanogen đã có văn bản gửi Thủ tướng mong muốn vaccine Nano Covax sớm được cấp phép khẩn, tương tự các loại của Nga, Trung Quốc và Ấn Độ.
Khác với các loại vaccine được sản xuất dựa trên kháng thể, vaccine Nano Covax được sản xuất theo công nghệ protein tái tổ hợp. Dựa trên đoạn gene mã hóa của virus SARS-CoV-2, nhà sản xuất tích hợp đoạn gene này vào dòng tế bào đang nuôi cấy để sinh tổng hợp protein, tinh tế và pha trộn.
Trả lời Zing, ông Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và Đào tạo, Bộ Y tế, cho biết: "Việc cấp phép khẩn cấp cho một loại vaccine phòng Covid-19 là điều cần thiết. Tuy nhiên, chúng ta phải dựa trên nguyên tắc đầy đủ các dữ liệu về mặt khoa học, chứng minh và trả lời được 3 câu hỏi: Có an toàn không, có sinh miễn dịch không và đặc biệt là có hiệu lực bảo vệ không?".
Theo ông Quang, loại vaccine này đang còn trong quá trình nghiên cứu, thử nghiệm và chưa có dữ liệu. Kiến nghị từ Công ty Nanogen rất khó được chấp thuận bởi đây thuộc thẩm quyền chuyên môn của Bộ Y tế. Để quyết định có cấp phép khẩn cấp hay không, cơ quan này cần có các dữ liệu khoa học.


